Adenosine Triphosphate-Bioluminescence 이용한 수술기구의 세척 후 청결도
Checking the Cleanliness of Surgical Instruments Using the Adenosine Triphosphate-Bioluminescence Assay
Article information
Trans Abstract
Purpose
Cleaning is crucial for reprocessing reusable surgical instruments (RSIs). In this study, we used the adenosine triphosphate (ATP) bioluminescence method to assess the cleanliness of RSIs according to the cleaning method used.
Methods
From April 3 to June 2, 2023, surgical sets, including hemostatic forceps, needle holders, operating scissors, dressing forceps, and suction tubes, that arrived at the decontamination room in the central sterile supply department of one general hospital were selected through convenience sampling. For each of the three cleaning processes, 30 cleaned RSIs were sampled with test swabs for inspection, and the relative light unit value was measured using ATP test equipment.
Results
Suction tubes, hemostatic forceps, and needle holders ranked low in cleanliness (x2=11.69, p=.020), and the contamination rate after mechanical cleaning was significantly lower than that after manual cleaning (x2=31.34, p<.001).
Conclusion
Surgical instruments treated by manual processing and those containing tubes were associated with the low cleanliness. Therefore, it is necessary to check whether surgical instruments, including tubes, are manually washed at an appropriate level, and regular monitoring will be required.
서 론
1. 연구의 필요성
의료 관련감염이란 의료행위와 관련된 모든 감염이다[1]. 수술 부위감염은 상황과 시대에 따라 다르지만, 두번째로 흔한 의료 관련감염이다[2]. 수술 부위 감염율은 국내에서 2.1%, 미국에서 2~5%, 개발도상국과 후진국에서는 11.8% 이상 보고되고 있다[3]. 수술 부위감염은 대개 수술 전후 및 수술 중의 각종 환경적 중요한 요인이 되므로, 수술 부위감염에 대하여 감시활동을 시행하여 수술 부위감염을 줄이는 것이 매우 중요하다[4,5]. 많은 국가들이 의료감염감시체계를 운영하고 있으므로, 수술 부위감염 감시를 시행하고 있다[6]. 우리나라에서도 수술 부위감염에 대한 감시활동은 2006년부터 전국 의료관련감시체계(Korean National Healthcare-associated Infections Surveillance System, KONIS)를 구축하여 운영하면서부터 수술 부위 감염율이 의미 있게 감소하고 있는 것을 보여주었다[7–9]. 의료기관에서 사용하는 다양한 환경과 의료기기는 감염 전파의 매개체 역할을 할 수 있으므로 적절한 멸균과 소독이 중요하다[10,11].
의료기기의 재처리 과정은 사용한 의료기구를 원래의 상태로 되돌리기 위한 것으로 세척, 검수, 포장, 소독 및 멸균 과정이 포함된다[12]. 세척은 멸균과 소독을 시행하기 전에 실시하여야 하고[13] 물과 세정제, 기계적 마찰을 이용하여 의료기구의 오염을 제거하는 과정이다[12]. 세척은 적절한 소독이나 멸균을 위한 필수조건으로 의료기관에서 세척에 대한 지침을 마련하고 지침에 따라 수행하며 이를 감시해야 하고, 사용한 의료기구는 사용 즉시 세척해야 한다[14–16]. 만약 세척을 빨리 진행할 수 없는 경우에는 유기물이 의료기구에 붙을 수 있으므로 건조되지 않도록 해야 한다[13].
의료기구를 재사용하기 위한 세척은 손세척 시행 후 소독과 멸균과정을 거치는 경우가 대부분이었으나[17] 자동세척장비의 개발로 기계세척으로 전환되고 있다. 자동기계세척은 손세척보다 일정한 농도의 세제, 온도조절, pH, 헹굼 공정 등을 재현할 수 있고[18], 재처리하는 직원이 혈액, 체액, 기타 잠재적인 감염원에 노출되는 위험을 감소시킬 수 있다[15]. 자동기계세척으로 전환하려면 높은 비용과 손세척 구역의 장비 설치에 대한 공간이 별도로 필요하다[19]. 의료기구의 손세척이나 기계세척에서 중요한 것은 의료기구 표면이 효과적으로 세척되었는지에 대한 평가이다. 기계세척의 경우는 세척 확인 지시계를 사용하여 세척을 확인할 수 있으나 손세척의 경우는 육안 검사를 통해 기구의 청결 상태를 확인할 수 있다. 복잡한 수술기구의 결합 부위, 내관이 있는 내시경 의료기구 등은 육안 검사로 충분하지 않을 수 있다[20]. 멸균과 높은 수준의 소독 여부와 관계없이 의료기구의 세척은 동일한 기준으로 수행되어야 한다[21]. 부적절한 의료기구의 세척은 생물막(biofilms) 형성을 촉진시켜 재처리 과정의 실패와 환자감염의 원인이 될 수 있다[19].
의료기구에 남아있는 유기물이나 미생물막이 멸균제의 침투를 막아 감염 원인균의 감염력이 존재할 수 있다[22]. Association of periOperative Registered Nurses (AORN)는 세척방법에 따라 손세척과 기계세척한 수술기구를 각각 59개 비교하여 16개의 오염된 기구를 확인했으며, 그중 14개는 손세척한 것으로 나타나 수술기구의 세척 효능에 대한 정량적인 시험방법으로 Adenosine Triphosphate Bioluminescence (ATP) 검사를 권장하고 있다[23]. ATP 검사는 세척된 기구 표면에 잔류하는 ATP의 양을 추정하는 것으로 ATP와 루시퍼라제-루시페린의 반응에서 생성되는 빛의 양인 생물발광을 측정되므로 기존 세척평가 방법보다 신속한 결과를 확인할 수 있는 장점이 있어 세척효과를 평가하기 위한 객관적인 방법으로 활용되고 있다. 또한 수술기구의 세척효과 평가에도 ATP 검사 방법을 이용하는 것이 적절한 것으로 판단되고 이를 권장하는 지침도 보고되고 있다[24]. 의료기관은 각기 다른 의료환경에서 세척이 이루어지고 있지만 최적의 상태에서 세척이 이루어졌을 때의 오염물 제거에 대한 정도 기준은 세척 검증을 위한 객관적인 지표가 필요하다[26]. 그러나 의료기구를 대상으로 세척후 청결도에 대한 영향요인과 ATP 검사를 분석한 국내 연구는 여전히 부족한 실정이다.
따라서 본 연구는 수술기구의 세척 후 청결도를 ATP 검사로 정량적으로 오염실태를 확인하여 의료기구 세척의 지속적인 질 평가를 위한 기초자료로 활용하고자 한다.
2. 연구목적
본 연구는 수술기구의 유형과 세척방법에 따른 세척 후 청결도를 ATP 검사로 세척 효과를 파악하기 위함이다.
구체적인 목적은 다음과 같다.
수술기구의 세척 후 청결도와 기준 통과율을 확인한다.
수술기구 유형과 세척 방법에 따라 세척 후 청결도와 통과율의 차이를 파악한다.
세척 후 청결도 통과한 수술기구 유형을 세척방법 별로 비교한다.
연구방법
1. 연구설계
본 연구는 중앙공급부서에서 세척한 수술기구의 세척 후 청결도에 차이가 있는지 확인하고, 세척 후 청결도에 영향을 미치는 요인을 파악하기 위한 횡단적조사연구(cross-sectional study)이다.
2. 연구대상
본 연구는 경기도 소재 1개 종합병원 중앙공급부서에서 일관성을 유지하고 편향을 줄이면서 복잡한 수술기구를 사용하는 단일과 단일수술로 선정하기 위해 정형외과 슬관절 인공관절전치환술 후 재처리중인 수술기구를 대상으로 하였다. 수술기구 중 사용빈도가 높고 구조가 복잡하여 세척이 어려운 지혈 겸자(hemostatic forceps), 니들 홀더(needle holder), 수술용 가위(operating scissors), 드레싱 겸자(dressing forceps)와 내관이 있는 흡인용 튜브(suction tube) 12Fr. 로 각 수술기구 30개로 구분하여 150개를 연구대상으로 선정하였다. 손세척의 경우 침적이 없는 손세척과, 세척 전 2분간 효소세정제에 침적한 손세척으로 구분하고, 자동기계세척 별로 배분하여 각각 비슷한 수가 되도록 표출하였다. 손세척 수술기구는 오염제거실에 도착하여 손세척이 완료된 수술세트 중에서, 기계세척한 수술기구는 포장조립실에서 포장 대기 중인 수술세트에서 편의 표출하였고 자동기계세척 장비는 Getinge Washer- Disinfector (S-8668, 스웨덴)를 사용하였다.
3. 자료수집
본 연구의 자료수집기간은 2023년 4월 3일부터 6월 2일까지 진행되었으며, 세척 방법에 따른 세 군간 실험의 확산을 막기 위하여 시간적 차이를 두었으며, 2023년 4월 3일부터 4월 21일까지는 세척실에서 손세척이 완료된 수술세트 중에서 대상 수술기구로, 2023년 4월 24일부터 5월 12일까지는 세척실에서 침적 후 손세척이 완료된 수술세트 중에서 대상 수술기구로 하였고, 2023년 5월 15일부터 2023년 6월 2일까지는 자동기계세척한 대상 수술기구로 포장작업실에서 포장 대기 중인 수술세트에서 편의표출하였다.
1) ATP 측정
세척 후 육안으로 건조가 완료된 기구를 선택하였다. 손세척을 한 수술기구는 에어건으로 수분을 충분히 제거하고 린트프리 타올에 기구를 받아 남은 물기를 살짝 제거하고 5분 건조 후 검사를 시행하였다. 기계 세척한 수술기구는 기구 바스켓 표면이 충분히 식은 후 동일한 방법으로 검사하였다. 스왑을 누르는 압력은 스왑봉이 30도 정도 휘도록 손잡이를 지긋이 누르며 왕복 2회 지그재그 선을 그리듯이 면봉을 돌리며 고르게 채취한다. 지혈 겸자, 니들 홀더, 수술용 가위, 드레싱 겸자는 손잡이를 제외한 기구의 끝에서 8cm까지와 오염에 취약한 하단 부분에서 채취하고, 흡인용 튜브는 하부 끝에서 8cm와 내부(내관)는 팁 입구에서 스왑이 들어갈 수 있는 2cm까지 측정하였다(Figure 1). 스왑은 Clean-Trace TM Surface ATP Swap Test (3M Health Care, Conway, United States)를 사용하고, ATP-bioluminescence 검사를 이용한 RLU (Relative Light Unit) 측정값은 Clean-Trace TM Luminometer LX25 (3M Health Care, Conway, United States)로 즉시 확인하고 분석하였다.
2) 수술 시간
수술세트의 시트에 기록된 수술방과 환자이름을 이용하여 전산시스템의 수술정보를 확인하여 조사하였다. 수술시간은 수술 시작시각과 수술 종료시각의 차이로 하였다.
3) 오염제거실 도착소요시간
오염제거실 도착 시 조사시트에 중앙공급부서 직원이 기록한 도착시각과 수술방과 환자이름을 이용하여 전산시스템에서 확인한 수술정보의 수술종료시각 차이로 하였다.
4. 자료분석
수집된 자료는 SAS ver 9.4 (SAS Institute, Cary, NC, USA)을 이용하여 분석하였다.
수술기구의 특성은 빈도와 백분율, 평균과 표준편차를 이용하여 분석하였다.
수술기구의 세척 후 청결도 측정은 수술기구 유형, 세척방법, 수술시간, 오염제거실 도착소요시간에 따라 평균과 표준편차, 중위값 및 범위로 분석하였고, ATP로 측정한 RLU 값이 150 이하인 경우를 세척 청결도 판정 ‘통과’로 간주하여 통과한 기구의 빈도와 백분율, 평균과 표준편차로 분석하였다.
수술기구 유형과 세척 방법에 따라 세척 후 청결도와 통과율의 차이를 파악하기 위하여 청결도 결과에 대한 정규성 검정을 시행하였고 Shapiro-Wilk test 분석결과 정규분포를 하지 않아 비모수 통계법인 Kruskal-Wallis H test 로 분석하고, 사후 분석시 다중검정에 대한 보정은 Bon-ferroni correction를 이용하였다. 수술기구의 유형과 세척방법에 따른 세척 후 청결도와 통과율의 차이는 x2 test 로 분석하였다.
5. 윤리적 고려
본 연구를 진행하기에 앞서 본 연구자의 기관에서 연구윤리심의위원회로부터 인간 또는 인체유래물을 대상으로 하는 연구가 아니며, 재사용 의료기구의 오염시간에 따른 자동기계 세척 후 청결도를 ATP 검사로 정량적으로 확인하여 의료기구 세척의 지속적인 품질평가를 위한 근거로 제시하고자 하는 연구로, 심사면제 대상에 해당한다고 판단되므로 심의면제 확인을 받고 수행하였다(NHIMC 2023-02-008).
연구결과
1. 수술기구의 일반적 특성
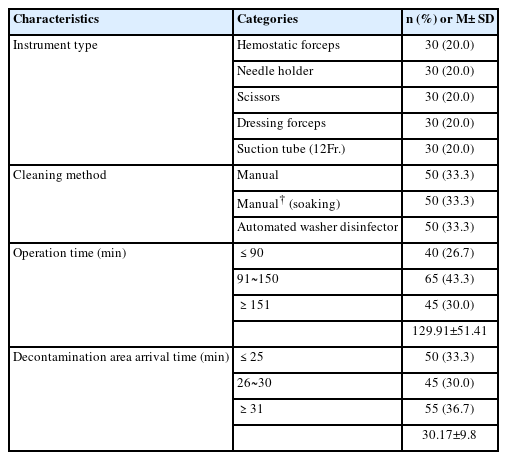
수술기구는 총 150개로 지혈 겸자 30개(20.0%), 니들 홀더 30개(20.0%), 수술용 가위 30개(20.0%), 드레싱 겸자 30개(20.0%), 흡인용 튜브 30개(20.0%)이고, 세척방법은 손세척 50건(33.3%), 침적후 손세척 50건(33.3%), 자동기계세척 50건(33.3%)였다. 평균 수술시간은 129.91±51.41분으로 101-180분 이하가 65건(43.3%)으로 가장 많았고, 평균 오염제거실 도착소요시간은 30.17±9.8분으로 30분 이내가 95건(63.3%)으로 가장 많았다(Table 1).
2. 수술기구 유형과 세척 방법에 따라 세척 후 청결도와 통과율의 차이
수술기구의 일반적 특성 중에서 수술기구 유형 (x2=11.69, p=.020), 세척 방법 (x2=31.34, p<.001)에 따라 청결도에 통계적으로 유의한 차이가 있었다. 수술기구 유형에서 평균 흡인용 튜브(427.7±558.62 RLU)의 청결도가 가장 높게 측정되었고 다음으로 지혈 겸자(147.23±282.93 RLU), 니들 홀더(117.67 ±145.45 RLU), 드레싱 겸자(115.53±115.32 RLU), 수술용 가위(73.6±66.32 RLU) 순이었으며, 흡인용 튜브와 지혈 겸자의 최댓값은 각각 2,128 RLU, 1,526 RLU이었다. 사후 분석 결과 흡인용 튜브가 지혈 겸자와 수술용 가위에 비해 세척 후 청결도가 통계적으로 유의하게 낮은 것으로 나타났다. 세척방법에서는 손세척 평균이 251.94±418.86 RLU로 가장 높고, 최댓값이 2,128 RLU로 확인되었다. 자동기계세척이 두 손세척 보다 세척 후 청결도가 통계적으로 유의하게 높은 것으로 나타났다. 수술 시간과 오염제거실 도착 소요시간은 통계적으로 유의한 차이가 없는 것으로 나타났다. 청결도 기준치(150 RLU 이하)의 통과는 113건(75.3%)으로 나타났고, 세척 방법 (x2=27,50, p<.001)에 따라 청결도 판정기준 통과율에 통계적으로 유의한 차이가 있었다(Table 2).
3. 세척 청결도 통과 수술기구의 세척방법별 청결도 비교
수술기구의 세척 후 청결도 판정기준 통과 도표는 Figure 2와 같다.
수술용 가위의 성공 통과율이 가장 높았고, 지혈 겸자, 드레싱 겸자, 니들 홀더, 흡인용 튜브 순으로 나타났다. 청결도 측정결과 통과로 판정 받은 수술기구만을 대상으로 하여 세척방법별 청결도 측정값의 중앙값 및 사분위 범위를 나타낸 상자 도표는 Figure 3과 같다. 손세척 방법 모두에서 RLU의 중앙값, 사분위수 범위가 자동기계세척 보다 높게 나타났다. 자동기계세척 과정의 중앙값이 가장 낮게 측정되었고, 사분위수 범위 내에서 가장 좁은 측정값이 나타났다.
논 의
본 연구는 수술기구의 세척 후 청결도가 수술기구의 유형과 세척방법별로 차이가 있는지 확인함으로써 올바른 재처리 지침을 준수하고 의료 관련감염을 예방하기 위한 기초자료로 제공하고자 하였다. 재사용이 가능한 의료기구는 멸균 전에 올바른 세척방법으로 세척 후 기준 이내의 청결도가 유지되지 않는다면 효과적인 멸균이 이루어질 수 없다[26].
본 연구에서는 자주 사용하며 상대적으로 복잡한 구조로 세척이 어려운 수술기구[27]를 비교하였다. 수술기구의 세척방법에 따른 세척 후 청결도의 차이를 파악한 결과 자동기계세척과 손세척 시 청결도에서 차이가 있음을 확인하였고, 효소세정제 침적 유무에 따른 손세척은 세척 후 청결도의 차이가 없는 것으로 나타났다. 수술기구 유형 중 흡인용 튜브의 세척 후 청결도 값이 가장 높았고, 청결도 판정기준에 의한 통과율도 가장 낮게 나타났다. 이는 유형이 복잡한 수술기구일수록 세척 후 청결도가 낮다고 보고한 선행연구들을 지지하는 결과였다[27–29]. 그러므로 흡인용 튜브 내관은 자동기계세척의 세척액이 접근하기 어려워 기계세척기로 세척하기 이전에 손세척을 이용하여 내관을 브러싱(brushing)과 플러싱(plushing)을 추가하는 것이 필요하므로 재처리를 담당하는 중앙공급부서 등의 업무 지침에 반영되어야 할 것이다.
Masia 등[30]의 연구에서는 수술기구 유형별 세척의 난이도에 따라 청결도에 차이가 있음을 확인한 결과 드레싱 겸자 팁의 홈부분(1,110.5 RLU)과 니들 홀더 하단 줄무늬 십자형 부분(1,184.3 RLU)의 청결도가 낮게 나타났고, 지혈 겸자(1,105.5 RLU)와 수술용 가위(1,184.3 RLU) 모두 손세척 후 청결도는 본 연구의 결과보다 세척 후 청결도가 낮게 나타났다. 이는 의료기관마다 의료환경이 다르고 세척 도구, 수질, 효소 세정제 등의 차이가 있으므로 비교하기는 매우 어려울 것으로 생각된다. 본 연구에서는 세척이 어려운 의료기구만 선정하여 세척 후 청결도를 검사하였다. 향후 의료기구에 대한 정기적인 세척 모니터링을 하기 위해서는 세척이 가장 어려운 의료기구만 선정하여 반복 연구한다면 세척이 쉬운 일반적인 기구는 청결도에 문제가 없을 것으로 생각한다.
또한, 선행연구에서 수술에 사용 후 세척 전 대기시간이 6시간이 경과하면 세균 수가 현저히 증가한다고 보고하고 있는데[31], 본 연구에서 수술시간과 세척 후 청결도는 통계적으로 유의한 차이는 없었으나 수술시간이 3시간이 소요되는 수술에서 사용한 수술기구의 세척 후 청결도 판정 기준 통과율이 수술시간이 짧았던 경우보다 통과율이 낮은 것으로 나타났다. 수술시간이 6시간 이상 소요되는 경우는 수술 도중 기구 사전세척을 좀 더 강화하여 시행하는 것이 세척 후 기구 청결도를 높일 수 있을 것으로 생각한다.
본 연구에서 36.7%의 수술세트가 30분 이후에 오염제거실에 도착하고 있음을 확인하였는데, 오염제거실 도착시간은 세척 후 기구 청결도와는 통계적으로 유의한 차이는 없었다. 그러나 사용한 의료기구는 가능한 사용 즉시 중앙공급부서의 오염제거실로 이동하여 세척을 시작하도록 권고하고 있고[13,32], 사용한 의료기구가 세척되기 전 소요시간의 증가는 부식의 원인과 관련이 있으므로[28], 세척 실패율을 낮추기 위하여 최대한 단축하여 운영해야 하며, 오염제거실 도착 지연과 관련된 요인을 파악하여 개선할 필요가 있을 것이다.
세척방법별 청결도 측정값은 Li 등[33]의 연구와 Jagrosse 등[34]의 연구에서 유사하게 두 방법의 손세척이 자동기계세척에 비하여 통계적으로도 청결도가 낮은 것으로 나타났다. 손세척 대상 수술기구의 ATP 검사 시행 시 세척 직원이 모니터링 대상임을 인지할 수 있는 상황이어서 평상시보다 강화된 방법으로 손세척을 수행하였을 것으로 추측됨에도 불구하고도 RLU 측정값이 높게 나타났다. 이는 의료기관마다 환경이 다르고 세척 직원의 올바른 지침 준수와 세척확인 지시계가 없고 육안 검사로만 세척을 확인하기 때문[16]에 객관성이 떨어질 수 있다. 국내 의료기관에서 아직도 손세척이 많이 이루어지고 있음을 감안[17]할 때 의료기구의 세척이 철저하게 수행되지 않을 가능성이 있으므로, 추후 자동기계세척을 확대하는 방안을 체계적으로 모색하는 것이 필요할 것으로 생각된다. 효소세정제와 세정제를 사용한 손세척 방법을 비교한 Alfa 등[35]의 연구에서는 효소 세정제로 손세척한 그룹에서 청결도가 높게 나타났다. 그러나 본 연구의 손세척 방법에서 효소 세정제에 2분간 침적 후 손세척 방법과 침적하지 않은 손세척 방법 간 세척 후 청결도는 통계적으로 유의한 차이가 없었다. 그러나 본 연구에서 세척 작업자의 세정제 지침 미준수 등으로 인하여 세척 후 청결도에 대한 침적의 효과를 파악하는데 제한이 있었으므로, 보다 다량의 수술기구를 대상으로 적용하여 그 효과를 평가하는 추후 연구가 필요하겠다. 재처리를 담당하는 중앙공급부서에서 의료기구 세척의 질관리를 위해 기계세척이 우선시되지만 장비가 부족하고 수술 중 의료기구의 오염으로 응급 재멸균이 필요한 경우, 대체할 의료기구가 없는 경우에는 기계세척보다는 손세척[17]을 해야 하는 경우가 빈번하므로 지침에 맞는 올바른 손세척 방법을 준수하는 것이 매우 중요하다고 생각한다. 의료기구는 환경에 노출시간이 오래되면 생물학적 부담을 증가시킬 수 있는 요인이 될 수 있으므로 재사용 기구는 세척 후 적시에 멸균을 위해 포장을 해야 한다. 그러나 의료기구 세척 후 멸균까지의 노출시간에 대한 적정 기준은 아직 제시되고 있지 않는 실정이다. 따라서 의료기구 재처리 사이클인 입고, 세척, 검수, 포장, 멸균의 적정 기준에 대한 추가 연구를 제언한다.
ATP 장비 사용지침서에 의료기구의 경우 전체를 충분히 문질러 검사하도록 되어 있으나, 본 연구에서는 수술기구별 청결도를 동일한 면적으로 비교하기 위하여 환경 소독시 제시한 표면적과 세척하기 힘든 부분을 측정값으로 하여 분석하였다. 절차는 튜브에서 테스트 면봉으로 수술기구 표면과 홈을 닦고, 튜브에 다시 넣어 루시페린-루시페라아제 용액에 침적한 후 부드럽게 3초 동안 흔든 후 기기에 넣고 15초 후 기기 화면에서 상대광도단위(RLU) 점수를 확인하였다. 추후 수술기구별로 검사 면적 표준화에 대한 연구가 제시되어야 유형별 의료기구의 청결도 차이를 확인할 수 있을 것으로 생각한다.
본 연구는 연구대상 표본이 1개 종합병원에 한정되어 있고 표본수가 적고, 다섯 가지 유형의 수술기구만을 대상으로 하였으며 의료기구에 대한 ATP-bioluminescence 검사 프로세스 단계에 대한 표준화도 이루어지지 않았기 때문에 연구결과를 일반화하는 데 한계가 있다. 최근 수술기구에 대한 청결도를 ATP 검사 방법으로 모니터링하는 것을 권장하고 있으나, 복강경 기구 등 세척이 어려운 다른 기구는 제외되는 한계가 있고, 실제로 이를 적용한 국내 연구는 매우 드물다. 그러므로 수술기구를 포함한 의료기기의 세척 방법을 표준화하고 적절한 모니터링 방법을 개발하는 후속연구가 필요할 것으로 보인다. 또한 의료 관련 감염을 예방하는 일차적 방법은 재사용 의료기기의 재처리 과정으로 의료현장에서 인력부족과 수가 등의 문제로 재사용 의료기기의 관리가 제대로 이루어지지 못하고 있으므로 재처리에 대한 감염관리 활동과 보상과의 수가체계도 개선할 것을 제언한다.
결 론
본 연구는 수술기구의 세척방법에 따른 세척 후 기구 청결도를 ATP 검사로 정량적으로 오염실태를 확인하여 재사용 의료기구 세척의 지속적인 질 평가를 위한 기초자료로 활용하기 위해 수행되었다. 본 연구에서 수술기구중 세척의 난이도가 높은 기구를 선정하여 세척방법에 따라 세척 후 청결도를 알아보았다. 수술기구중 내관이 있는 흡인용 튜브의 청결도가 가장 낮게 나타났으며 자동기계세척이 손세척 보다 청결도가 높게 나타났다. 본 연구는 1개 종합병원을 대상으로 다섯 가지 유형의 수술기구만을 대상으로 하였으며 기구 테스트 범위에 대한 표준화도 이루어지지 않았기 때문에 연구결과를 일반화하는 데 한계가 있다. 의료기구의 세척과정을 표준화하고 적절한 모니터링 방법을 개발하는 후속 연구가 보완되어야 할 필요가 있다.
Notes
CONFLICTS OF INTEREST
The authors declared no conflict of interest.
AUTHORSHIP
Study conception and design acquisition – Park HH, Lee SS, and Kim SM; Data collection – Park HH, Lee SS, and Kim SM; Data analysis & Interpretation - Park HH; Drafting & Revision of the manuscript - Park HH.
DATA AVAILABILITY
Please contact the corresponding author for data availability.